藥事委員會作業
竹山秀傳醫療社團法人竹山秀傳醫院
藥事委員會新藥申請辦法
1. 本辦法所謂新藥,係指本院尚未採用,即無相同主成份、同劑量、同劑型之藥品,稱之為新藥。
2. 申請資格及條件:
2.1. 申請醫師需具備本院主治醫師以上之資歷。限相關科別本院專任醫師者,若其他人員或單位有需求者,亦應透過主治醫師申請。
2.2. 特約醫師若有需要提出申請時,需請科部主任簽核後依本辦法提出申請。
2.3. 主任委員無提新藥申請之權限。
2.4. 每位醫師於每次新藥審查時,於同一次會期只能提出二件新藥申請案。上述提及新藥包括該會期間所提之緊急採購藥品。
2.5. 申請醫師應於小組會議時出席報告。
3. 新藥申請原則:
3.1. 符合下列條件之一者始可提出新藥申請:
3.1.1. 已於衛生署完成查驗登記臨床試驗並有一家本院認定之醫學中心正式進藥者 (檢附衛生署核可之臨床試驗報告及進藥證明)。
3.1.2. 已於一家本院認定之醫學中心完成臨床試驗並正式進藥者 (檢附臨床試驗報告及進藥證明)。
3.1.3. 無臨床試驗報告但已有二家本院認定之醫學中心正式進藥者 (檢附進藥證明)。
3.1.4. 文獻明確、藥理作用獨特且本院無其他替代品者 (檢附參考文獻)。
3.1.5. 另於新藥審查會期前如有緊急迫切需要者,得以〝藥委會緊急採購〞為之。3.2. 本院已有同成份、同劑型、同劑量者不得以新藥提出申請。
3.3. 新藥申請如未獲通過,而該科認為確實需要,申請醫師可提出提案說明並於下一次藥委會提出口頭報告;如仍未獲大會通過,則該藥須隔ㄧ個會期(第8個月)後才可再提出申請。
備註:本院認定之醫學中心為台大、北榮、中榮、高榮、三總、成大、林口長庚、馬偕、高醫、中國、中山、彰基、奇美、國泰、高雄長庚、花蓮慈濟、萬芳、新光、亞東(依據2022年醫院評鑑及教學醫院評鑑合格標準公告為19家)。
3.4. 新進藥品申請時之基本條件限制3.4.1. 新藥申請應該要有取代或比價品項,提藥醫師應於新藥申請單中提出同類藥品中擬刪除之藥品品項,否則由藥劑科主任主動提出擬刪除之藥品品項供藥委參考。
3.4.2. 特別申請案之品項,即無比價品項或取代品項者,必須是本院新藥理機轉或新臨床用途之新藥(由新藥初審小組及藥劑科確認)。
3.4.3. 如不符合上述一、二點特別申請案之條件,仍需特別申請時,必須詳細說明特別申請原因,並於藥委會新藥審查時列席說明。
3.4.4. 新藥初審小組審查新藥時,必需評估申請之新藥與院內類似品項,利潤面之因素。
4. 新藥初審:
為加快藥委會審議速度,並避免重複提藥之考量,新藥申請前,須經由藥劑科進行新藥申請初審,審議通過後始進入藥委會議程討論。
4.1. 設置新藥初審目的
4.1.1. 確認是否符合新藥申請之定義,院內是否已有相同品項。
-
確認特別申請案之品項,即無比價品項或取代品項者,是否是本院新藥理機轉或新臨床用途之新藥,否則由藥劑科主任主動提出擬刪除之藥品品項供藥委參考。
-
確認新藥申請所附資料及資格是否完整或相符。
-
確認申請之新藥是否為之前院內已刪除之藥品,是否符合半年內不可再提藥之規定。
-
避免廠商事先繳交無意義之審核費用。
-
完成以上初步審核,加快正式藥委會之審議速度。
4.2. 新藥初審過程:
4.2.1文件繳交至藥劑科主任後由執行秘書嚴謹評核資料,資料不全或不合規定應通知提藥醫師。
4.2.2本會執行秘書將初審資料彙整後,得通知主席及各委員進行開會審核。
5. 新藥申請費用:
5.1. 每件申請案需繳交審查費二千元整。
5.2. 廠商備齊資料送交本院藥劑科無誤後,由本院藥劑科開繳費單,至出納組繳納費用,當日可至會計課領取繳費收據。
5.3. 如未於期限內將繳費證明送回藥劑科者,該申請案視為主動放棄。
5.4. 新藥申請案件於藥委會期審核後,不論申請通過與否,本院皆不退回新藥申請費用。
6. 新藥藥品管理費
6.1. 因藥品管理需要許多人力,擬收取藥品管理費以增進藥品管理效率。
6.2. 每件新藥申請案通過後需繳交藥品管理費。
6.3. 費用如下:
1)新藥進藥前須繳交藥品管理費,費用如下:
2)體系採購處完成議價並設好體系碼,至出納繳交藥品管理費用貳萬伍仟元整,始得進藥。
3)體系藥委通過的品項,竹秀端若需進用,需由體系採購處開單,至竹秀出納繳交藥品管理費用貳萬伍仟元,始得進藥。
6.4. 由本院藥劑科開繳費單,至出納組繳納費用,當日可至會計課領取繳費收據。
6.6. 若未繳納,則不予進藥。
7. 申請案收件時間:
7.1. 一般藥委會流程:每四個月開會一次,每年4、8、12月。
7.2. 新藥申請收件期間:申請人得隨時向本院藥事委員會提出新藥申請。
7.3. 經資格審查合格者,應於本院藥事委員會議召開日四週之前,備齊相關文件送交藥事委員會審議。
7.4. 收件截止於每四個月的最後一個月截止收件,即3、7、11月份截止收件。
7.5. 於藥委會新藥審查會期前,藥劑科初審小組亦會公告截止申請案截止收件日期。
7.6. 於收件截止日前資料仍未齊全者,該新藥申請案件不列入該次審查議程,併入下次會期之新藥審議。
8. 新藥申請案應附資料:
8.1. 新藥申請單(申請醫師填寫完整後經科部主任簽章)
8.2. 藥品資料表
8.3. 同類藥品比較表或相關比較資料(需含藥物動力學及藥品療效相關比較)
8.4. 藥品許可證及仿單(中英文)說明書影本
8.5. 下列任一新藥申請資格證明一份:8.5.1. 已於衛生署完成查驗登記臨床試驗並有一家本院認定之醫學中心正式進藥者:檢具衛生署核可之臨床試驗報告及該醫學中心藥委會通過之證明文件、合約影本或三個月之連續發票。
8.5.2. 已於一家本院認定之醫學中心完成臨床試驗並正式進藥者:檢具該家醫學中心之臨床試驗報告及藥委會通過之證明文件、合約影本或三個月之連續發票。
8.5.3. 無臨床試驗報告但已有二家本院認定之醫學中心正式進藥者:檢具該二家醫學中心藥委會通過之證明文件、合約影本或三個月之連續發票。
8.6. 健保局給付資料及相關規定(包括健保核價最新資料、藥品代碼、健保限制)
8.7. 臨床試驗報告(經本院藥委會核准之臨床試驗案,得繳交此報告)
8.8. 參考文獻(以二篇為限)
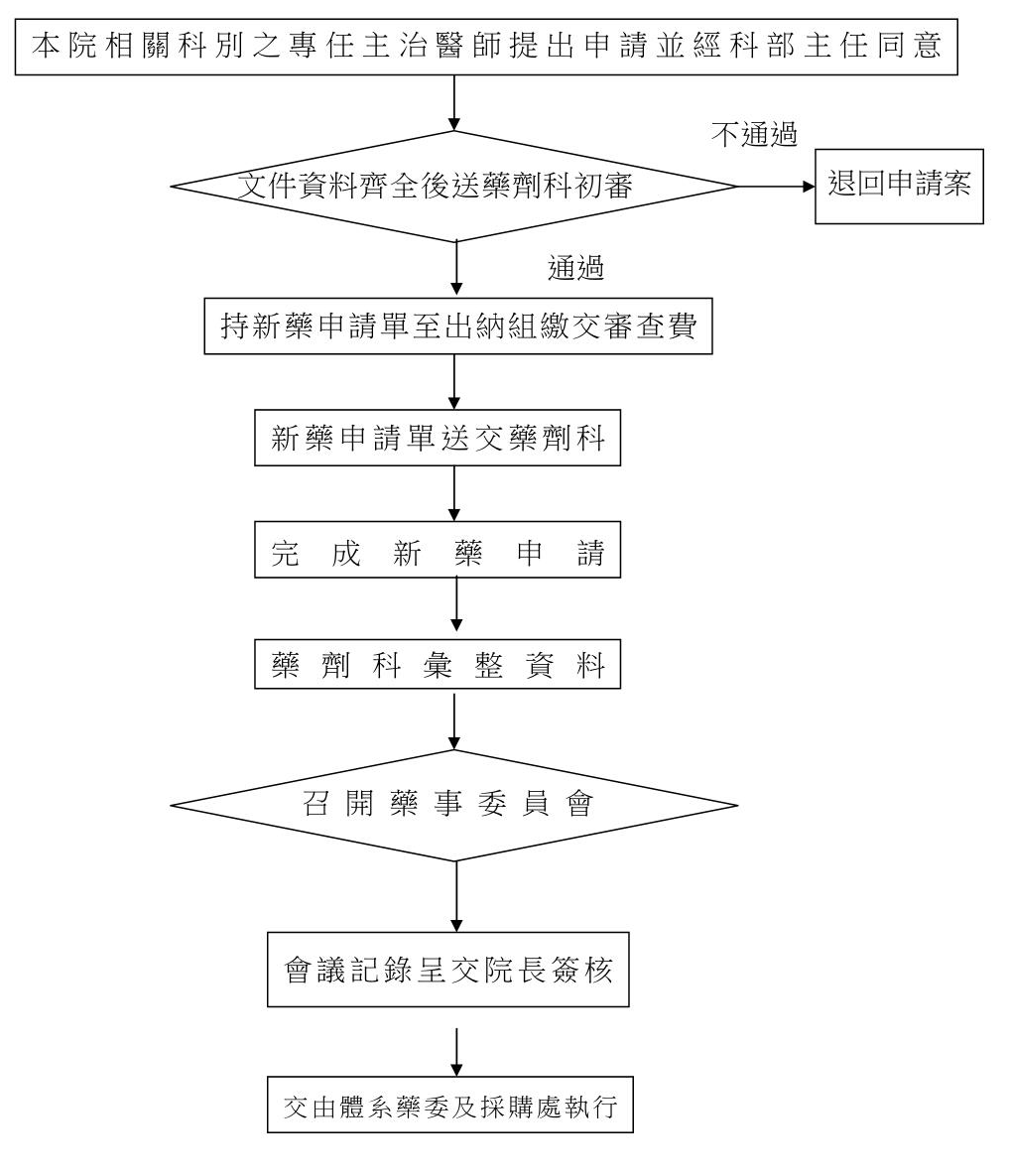
9. 新藥申請程序:
9.1. 申請醫師至本院藥劑科網路首頁直接下載新藥申請單。
9.2. 按新進藥品申請單填寫基本資料。
9.3. 由申請之專任主治醫師送交該科部主任審核及簽章。
9.4. 連同完整資料文件送件至藥劑科初審。
9.5. 持新藥申請單至出納組繳交審查費。
9.6. 將繳費證明送回藥劑科後始完成新藥申請程序。
9.7. 初審過藥品由藥劑科進行新藥評估整理。
9.8. 藥劑科彙整提報藥事委員會討論。
9.9. 經藥委會審核通過後,至出納組繳交藥品管理費,再至會計課領取繳費收據。
9.10. 進入本院藥委會審查後,再交付體系聯合藥委審查後,由採購處進行下一個動作。
10. 新藥申請注意事項
10.1. 經藥委會審核通過之品項,經使用半年後,於下次藥委會提出使用情況報告,供委員參考。
10.2. 經藥委會審核通過之正式品項,應列入處方集中管理。
10.3. 經藥委會決議後未通過審核之新藥、及被刪除之本院已有藥品,於下會期內不得再次提出申請。
10.4. 藥委會決議之結果,需紀錄於會議記錄中備
新藥申請 相關資料文件排列順序
為避免資料散失,並加速審核作業,請將必備文件依序由上往下排列:
-
新藥申請單
-
藥品資料表(由廠商填寫)
-
同類藥品比較表或相關比較資料(需含藥物動力學及藥品療效相關比較)
-
藥品許可證及仿單(中英文)說明書影本
-
下列任一新藥申請資格證明一份
醫學中心之1. 藥品採購合約書或2.藥委會通過證明文件或3.連續發票(近期連續3個月至半年)影本或4.其他證明文件等
-
健保局給付資料及相關規定(含健保核價最新資料、藥品代碼、健保限制)
-
臨床試驗報告(經本院藥委會核准之臨床試驗案,得繳交此報告)
-
參考文獻(以二篇為限)
-
出納組審查費用繳交並蓋章,並於一星期後到會計課領取收據證明
註:新藥申請之送件,於當次開會前一個月截止,之後送件則排入下次新藥申請之流程。
11. 新藥審查作業流程:
|
|
|

